今週より神経領域についての重要事項をまとめていこうと思います。
2021年6月に脳卒中ガイドラインが本邦で6年ぶりに全面改定を受けました。
その後も2023年に追補を受けていますが、差し当たりの大まかな趨勢を書いていきます。
テーマが広すぎるので、くも膜下出血、脳出血、脳梗塞の3編に分けていこうと思います。
まあ、それでも膨大すぎますが、、、笑
では今回はくも膜下出血についてです。
疫学や好発部位
まず疫学ですが、最多の原因は動脈瘤性です。

若年の女性に多いことが特徴で、それだけで他の脳卒中とは異質なものという印象を受けます。

特に日本はSAH大国であり、海外と比較して発症が多いと言われています。
喫煙率の高さなどが、原因の一つとして疑われています。
最多の原因でもある動脈瘤ですが、好発部位は決まっています。
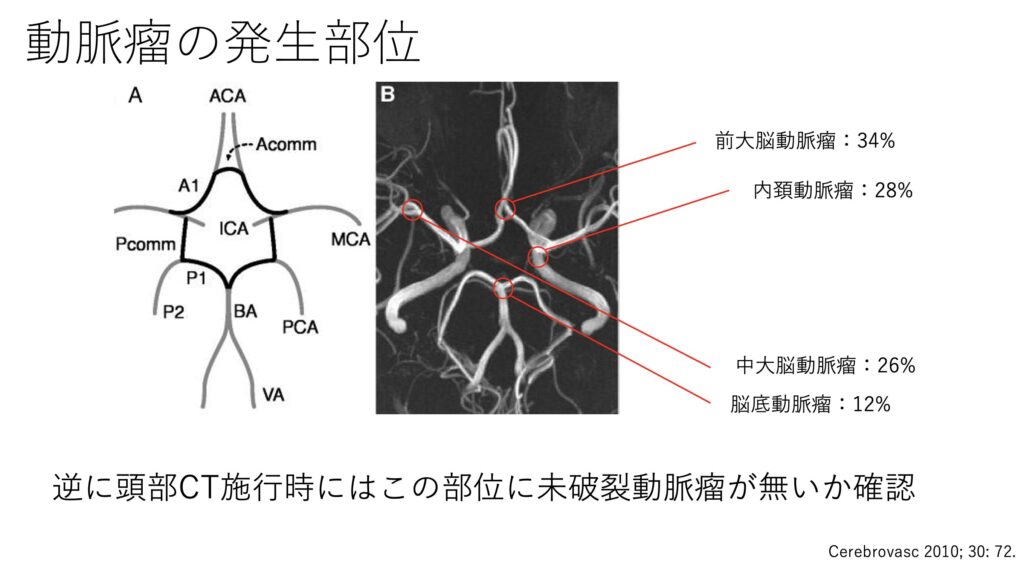
この場所によっても治療選択が変わってくることがあるので、脳外科医へコンサルする時にきちんとプレゼンできると良いですね。
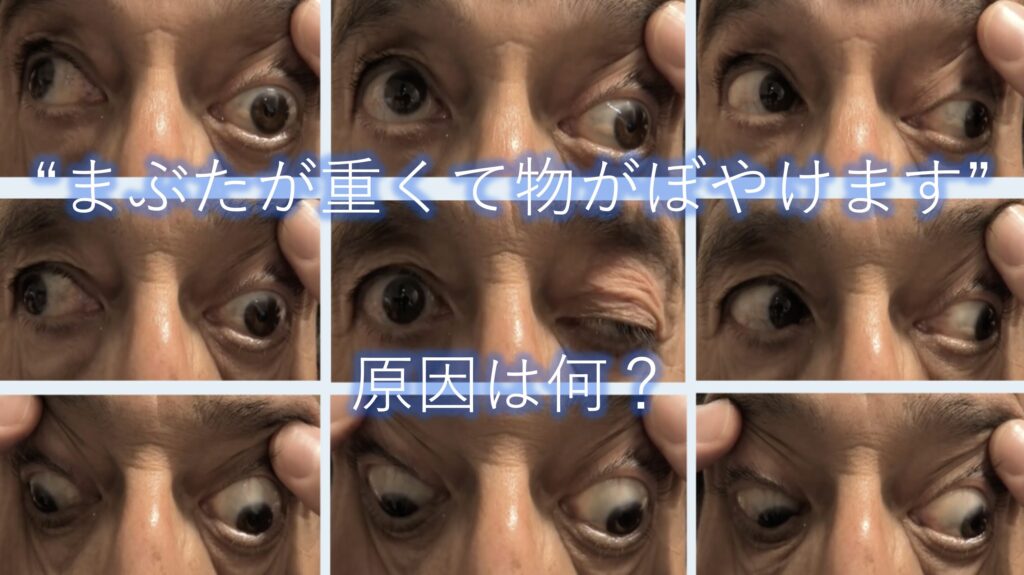
さて「まぶたが重くて、物がぼやける」といった主訴でいらした方。何を疑いますか?
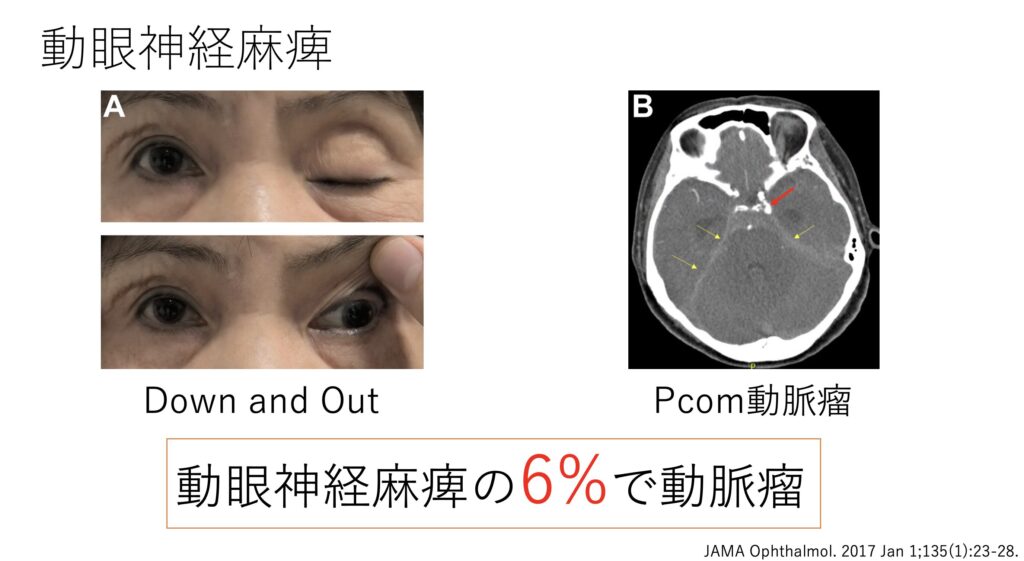
そうですね、この症例は動眼神経麻痺になります。
国試的には動眼神経は「副交感神経線維が外側を、外眼筋への神経線維が内側を走っている。微小血管の障害(例:糖尿病)だと血流悪くなり内側から障害されるため、眼球運動障害のみ先行する場合もある。 また動脈瘤だと外側が先行して、先に散瞳する場合がある。」などと言われます。
ですが、この理論をもって外からの圧迫(=動脈瘤)を考慮しないのは危険すぎます。
頭痛が無いとしても診断を付けることに意義がありますので、初発の動眼神経麻痺ならば動脈瘤を考慮しての画像評価は必須になるでしょう。
clinical prediction rule(CPR)
続いてCPRです。
CRP(C reactive protein)が大好きなお医者さんは多いですが、負けじとCPRも好きな方多いですよね。
SAHの有名なCPRにはOttawa SAH ruleがあります。

一見してどうでしょうか。40歳以上には使えない、ということでほとんど使う機会ないですね。
がっかりした方もいるかもしれませんが、SAHという致死的な疾患に対するCPRは極めて高い感度が求められます。
見逃したら死ぬからです。
なので検査前確率が低い症例には使っても良いですが、少しでも疑う症例にはそもそも使わない方が良いでしょう。
最もそのような症例は雷鳴頭痛などで、引っかかるように出来ているのですが。

実際、詳しく掘り下げてみると感度100%ながらも怪しさもありそうです。
そしてこのCPRをさらに強気に活用したのが、本邦発のEMERALD SAH ruleです。
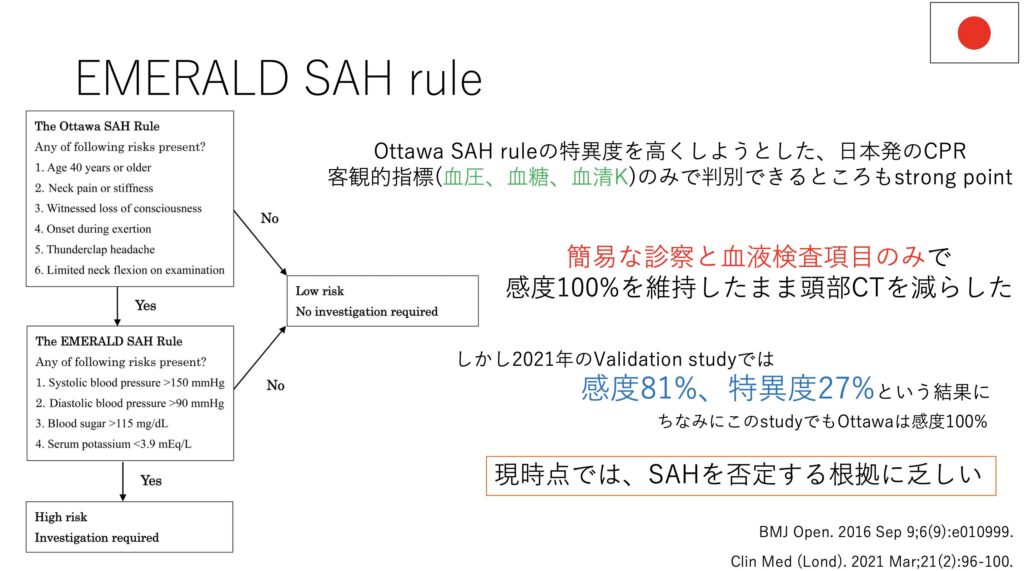
Ottawaに加えて血圧、血糖、Kで判別するという試みになります。
確かにSAHの方は凄まじいカテコラミンサージを受けるので、Kは細胞内シフトして下がり、血糖や血圧は上昇することをよく経験します。
ただこちらもvalidation studyにおいて、感度が不十分とされてしまいました。
やはりSAHを疑うのであれば、頭部CTを撮らないわけにはいきませんからね。
SAHに対するCPRは相当正しく使わないと難しいと思います。
検査
さて、ではSAHを疑った際の検査は何を行ったら良いでしょうか。
順に解説していきます。
①単純CT
とりあえずCTと思ってください。これが第一選択にならないことはあり得ません。

注意点としては発症早期(6時間以内)であれば、感度は100%と言われています。
ただ他にもpitfallはありまして、、、
読影が難しい場合があるという事です。
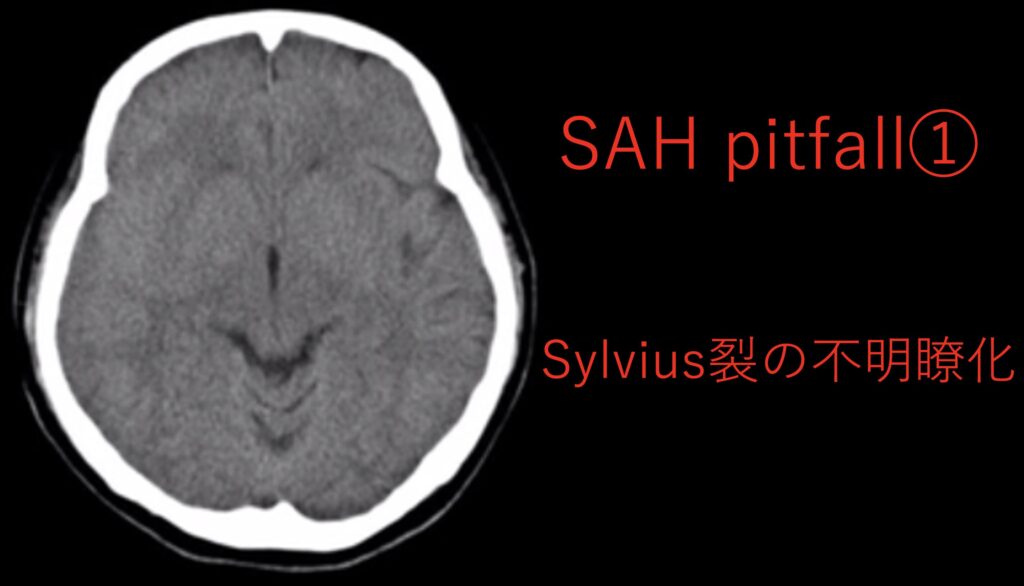
一つ目はわずかなSylvius裂の左右差で気付かれた症例です。
左右差に注目しないと気がつきませんね。
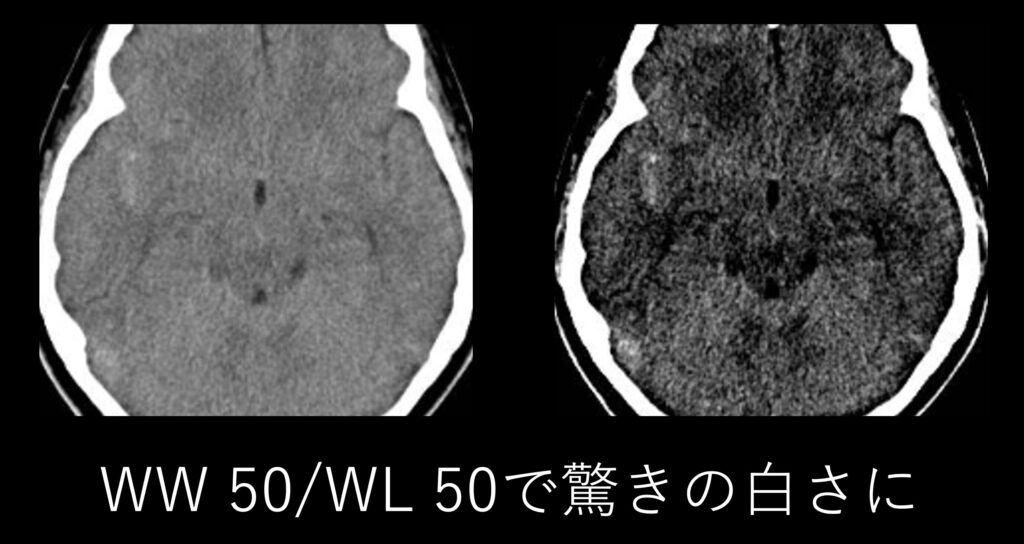
コツとしてはWW/WLを調整することで見やすくできます。
次は側脳室下角の拡大のみで気付かれるパターンです。
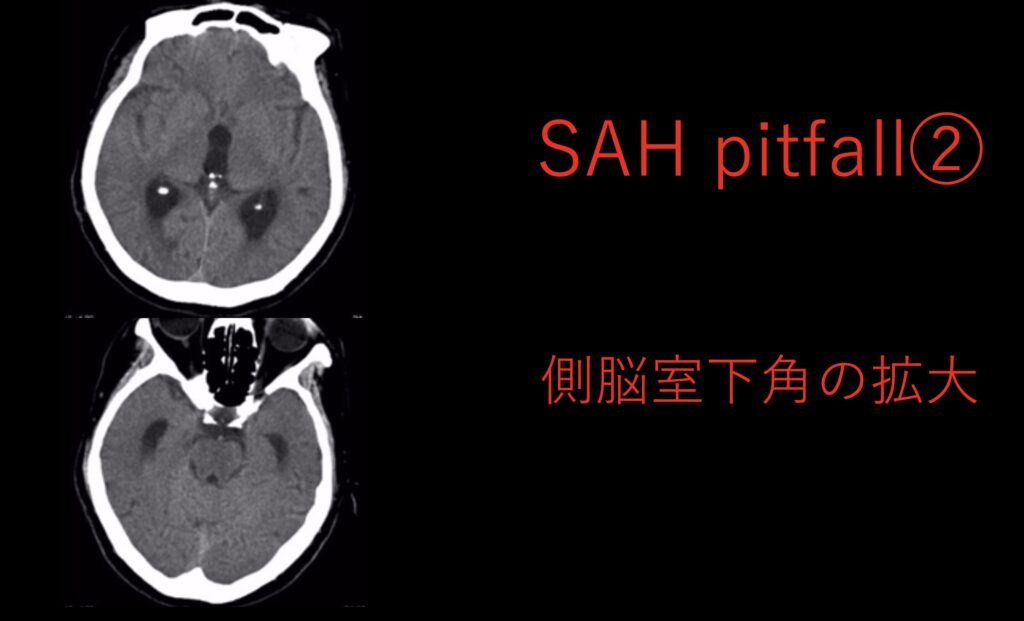
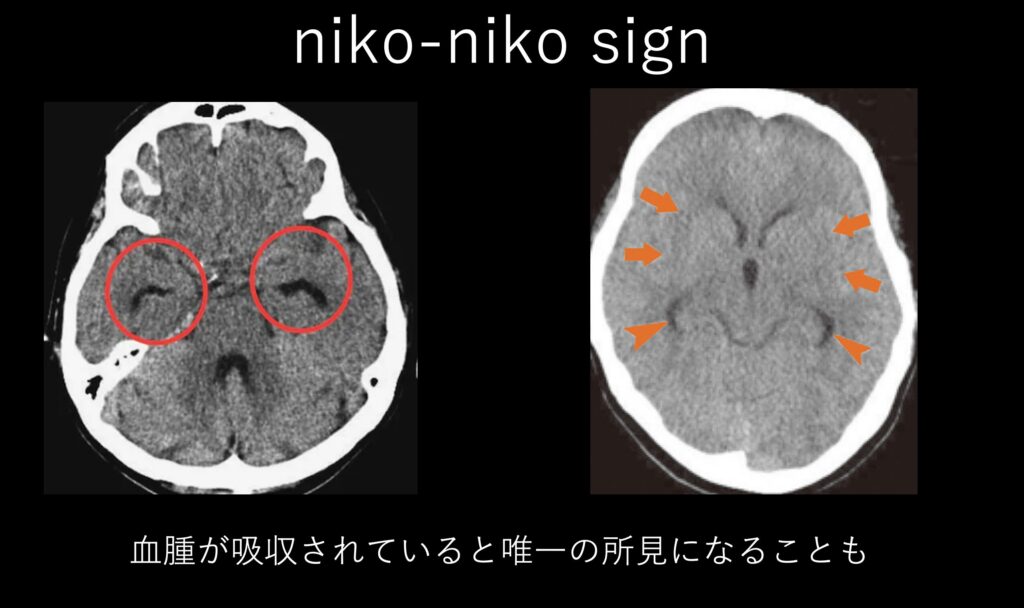
時間が経って血腫が目立たない場合には、唯一の所見になることもあります。
②腰椎穿刺
発症早期ではあるが6hを少し過ぎているくらいだと、MRIでも偽陰性になる可能性があります。
そのため腰椎穿刺の出番となります。
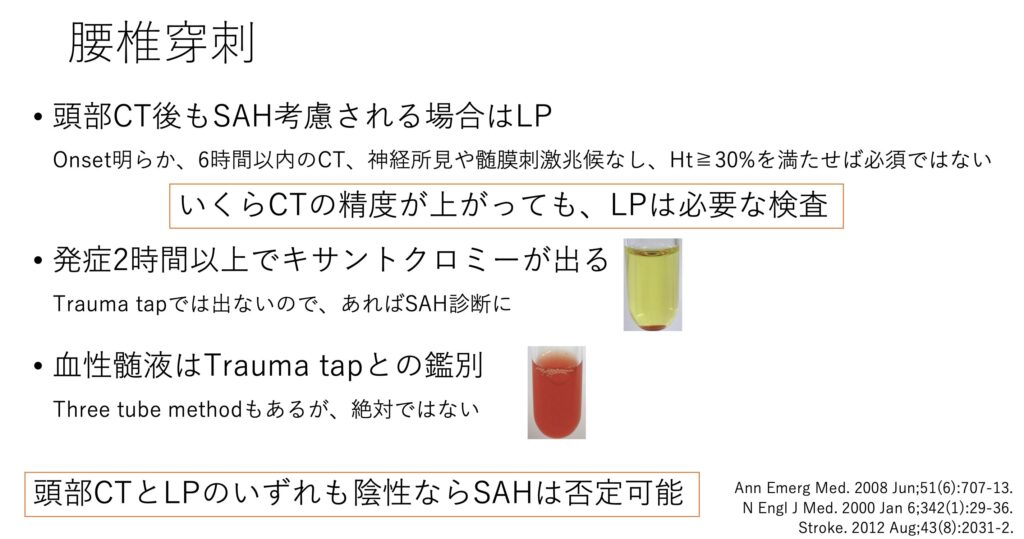
ただこのキサントクロミーなどをきちんと検査で同定できる施設はかなり限られていると思います。肉眼的に明らかであれば分かりますが、現実的にはあまり行われなくなってきている検査でしょう。
③MRI
次はアクセスとの兼ね合いですが、MRIです。
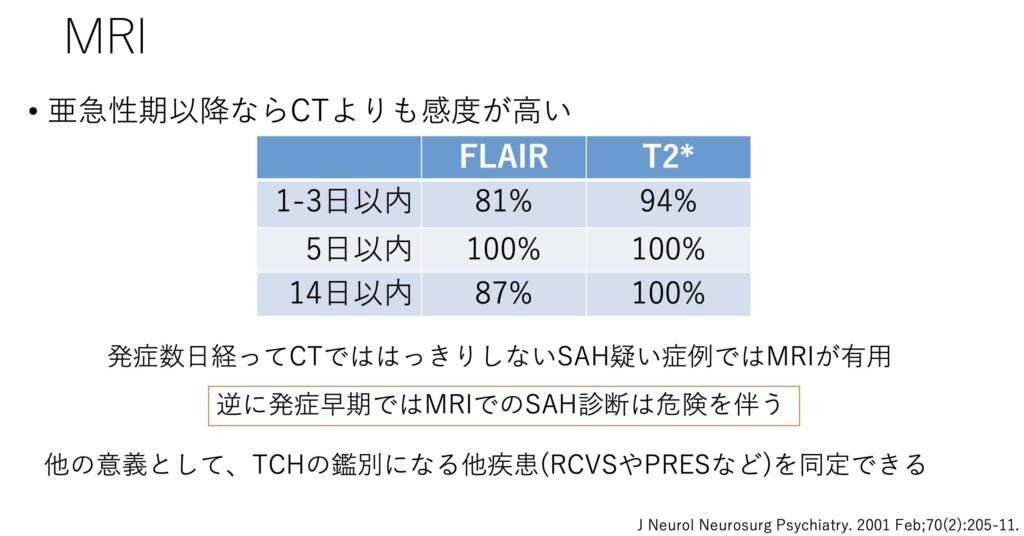
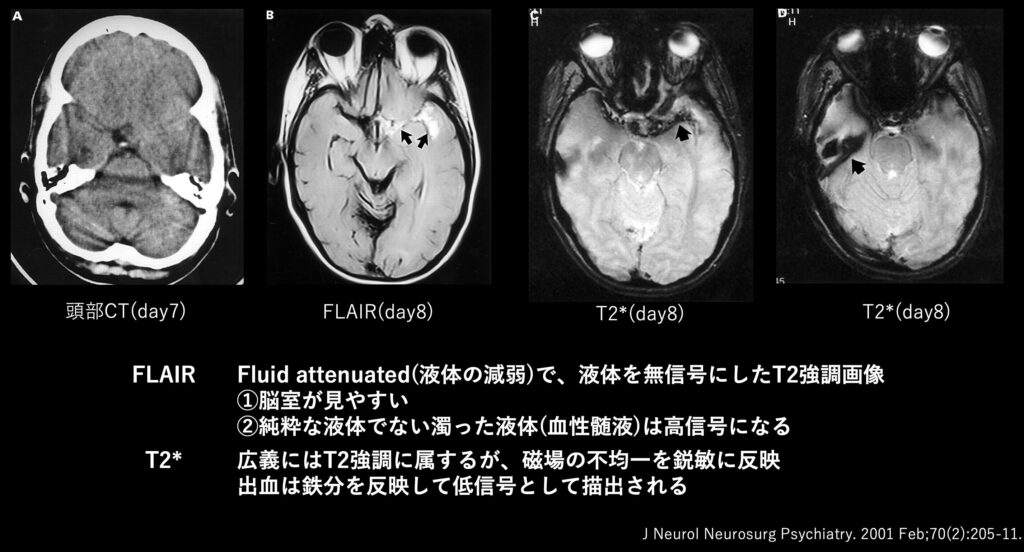
やはりCTで分からない時に、設備があるなら第二選択は多くの場合でMRIになると思います。
やはり他のTCHの鑑別になる疾患の診断もできる可能性があるのは大きなメリットです。
時間が経っていれば、特にMRIの感度は高くなるので有用性が上がります。
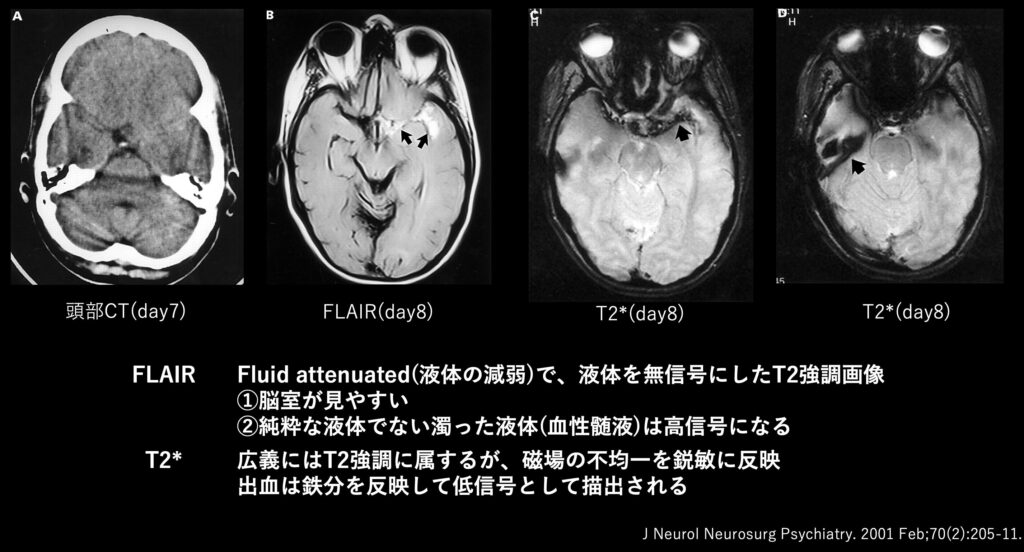
④CTA

CTAはSAHの診断ではなく、あくまでも「動脈瘤」を探すために行います。
そのためSAHの診断がついた後に行う検査だと思ってください。
これらをまとめた、自分の個人的な鑑別および検査のFlowが以下になります。
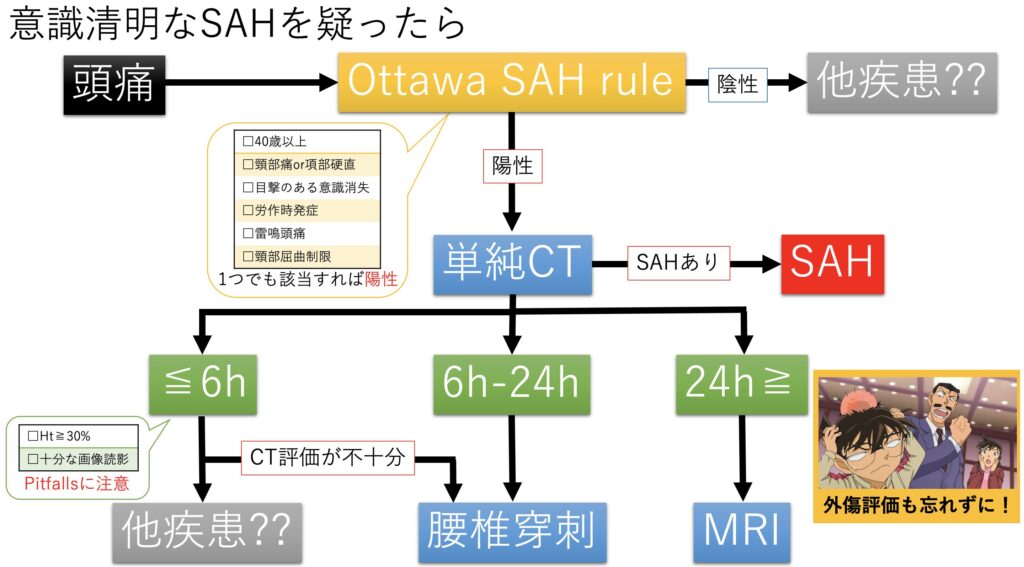
使うCPRはOttawaのみです。そしてCT撮像後に時間経過に応じて、追加の検査を検討します。
Flowだと腰椎穿刺が多いですが、現在所属の施設では現実的にはMRIに流れることがほとんどです。
分類
次は診断がついた後の分類についてです。
これらが神経学的所見と意識レベルをもとに判断する「重症度分類」です。

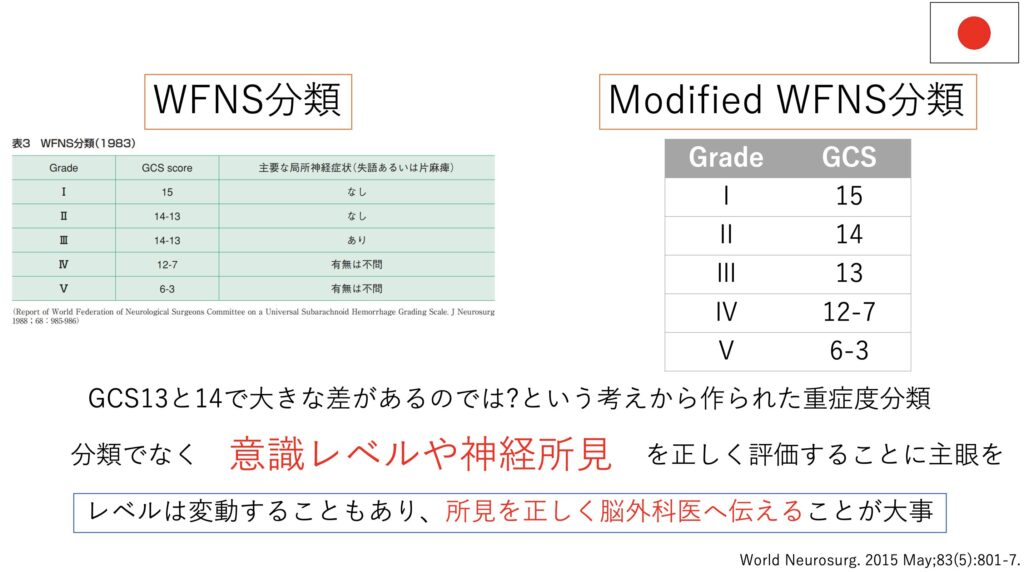
また併記されることが多いFisher分類は重症度ではなく「Spasm」リスクとの関連を示したものです。
Fisher分類だとGrade3が一番リスク高いというのがややこしいですね。
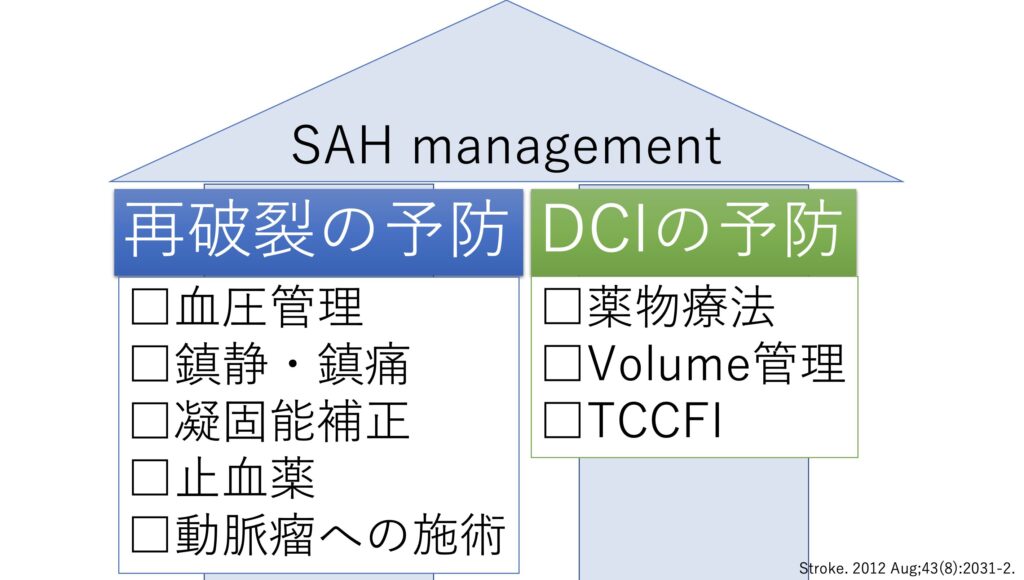
術後管理
大きくERにいるうちの超早期合併症「再破裂」を防ぐ事と、数日経ってからのSpasmに代表されるDCI予防を行う事の2つの軸に分けられます。
再破裂は本当に致死的です。

自分もERで何度も経験しましたが、大きく体がビクッ!となるのも見た事ありました。
間に合わなかったか・・・って気分になります。
血圧管理は難しいですが、低すぎても低還流になる害も大きいです。

極端な高値を避ければ良いでしょうが、手術する脳外科医のプラクティスに従う方が無難でしょう。
また猫も杓子もなトラネキサム酸ですが、さすがにaSAHにはあまり意味がなさそうでした。

まあ動脈瘤ですから、そりゃそーだって感じですね。
こちらはAHA2023でも、本試験の結果を受けて同様の扱いがなされていました。
そして最も根本的な再破裂の予防・・・そうです、治療ですね。
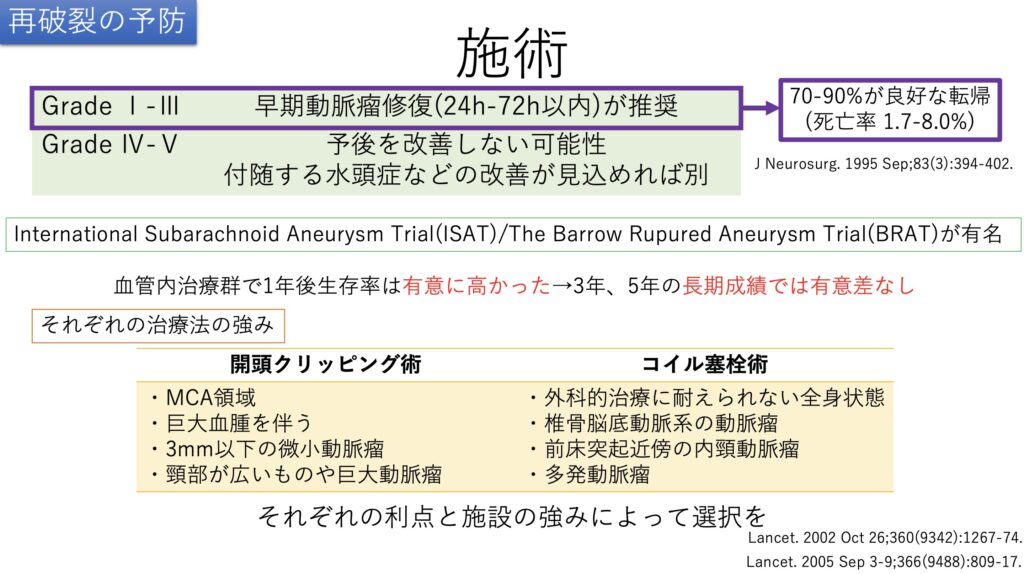
動脈瘤の位置や形態から開頭クリッピング術かコイル塞栓術が選択されます。
続いて術後の管理です。
以前は雑多にspasmと呼ばれていましたが、現在はspasmを含む脳虚血をdelayed cerebral ischemia(DCI)と呼称しています。
薬物療法ではニモジピンの一強です。

ただ本邦では未だに採用なく、使用が出来ません。
一方で、以前扱いましたが、クラゾセンタン(ピヴラッツ®︎)の扱いが面白いですね。
AHA/ASA 2023のガイドラインでは記載がもはや消失した薬ですが、国内では人気が出ています。
実際に脳卒中ガイドライン2023追補では、追記されているほどです。
機序としては確かにspasmを減らすのでしょう(脳外科医は断言していますね)が、問題は脳浮腫リスクだと思います。
結局ICPを上げてしまうことにより、DCIは減らす事ができずhard outcomeの改善には繋がらないのではないでしょうか。
あくまで仮説にすぎませんが、、、
逆に言えば、症例を選べば高額なことに目を瞑ればピヴラッツは良い適応かもしれません。
高齢女性で脳萎縮しており血腫量が多い場合などは、spasmさえ防げばよさそうなので入れても大丈夫かもしれませんね。
やはり個別化した医療を心掛けていきたいものです。

また循環血漿量についてもhypovolemiaは避けるべきですが、以前のようなむやみに輸液したり血圧を上げたりという管理は避ける事が推奨されています。
前述のAHA/ASA 2023ガイドラインではミルリノンの記載があり、むしろ心拍出量を増やすというものがありました。
根拠は弱いですが、理論的にはこちらの方が効果はありそうですね。
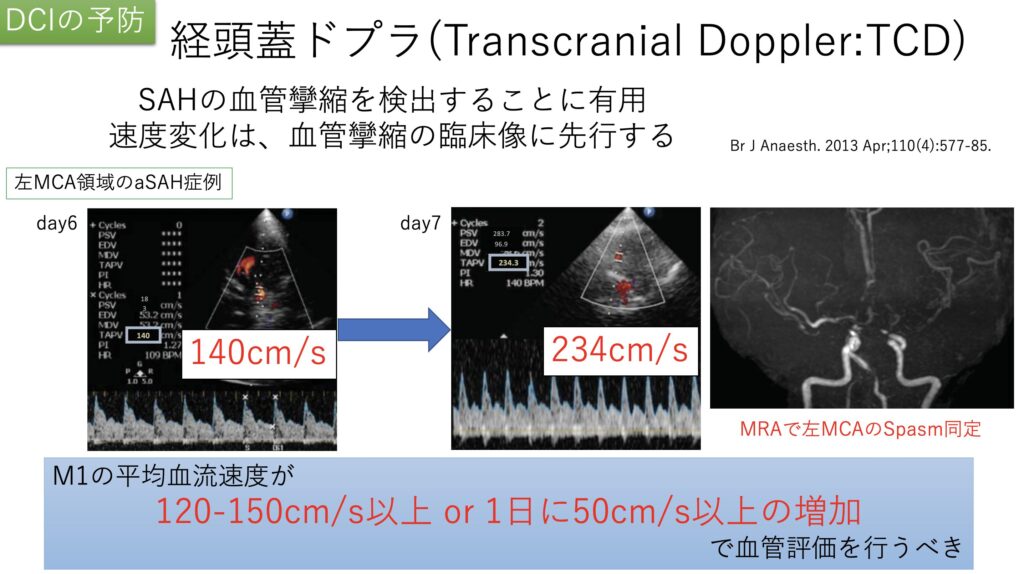
最後に経頭蓋ドプラエコー(transcranial doppler:TCD)についてです。
攣縮を流速速度の変化で同定します。
変化がみられたタイミングで先に画像評価に行く事で、致命的な合併症をきたす前に介入することにつなげられます。
さて、いかがだったでしょうか。
今回は疫学から診断、分類、検査、治療、術後管理などについてまとめました。
よければこちらの記事にくも膜下出血の管理に関するガイドライン(AHA/ASA 2023)をまとめましたのでご覧ください。
本日はこの辺で、ではでは。



コメント