今日は日常診療で実際に起こった事を調べてみました
呼吸不全でVV-ECMO管理をしていた症例でのトラブルで、次第に酸素化不良をきたしショックとなりました
VV-ECMOの管理の肝に「心機能が担保されている」という事が挙げられますが、今回の症例は「むしろ心拍出量が増えすぎた」ために低酸素、ショックとなった珍しい症例でした
以下に論文をあげます
〈本論文の一言まとめ〉
VV-ECMOでの低酸素は回路の酸素分率、本来の心拍出量に対するECMO流量の比率、酸素消費量、本来の肺機能、再循環(recirculation)などが鑑別にあがる
自己心が強すぎるとダメな肺を回ってしまい、逆に低酸素になることも!
Bhoumesh Patel, Michael Arcaro, Subhasis Chatterjee
Bedside troubleshooting during venovenous extracorporeal membrane oxygenation (ECMO)
J Thorac Dis. 2019 Sep;11(Suppl 14):S1698-S1707.
venovenous extracorporeal membrane oxygenation (VV-ECMO)は呼吸不全での低酸素血症と高二酸化炭素血症を管理し、「肺を完全に休ませる」ことで回復を促す目的で導入する
通常の人工呼吸器管理では限界で炎症により肺損傷が予想される際に行うが、管理は難しい
ECMOでの呼吸器設定駆動圧(プラトー圧-PEEPのこと、driving pressureやΔPとも言う)を低く保つことは、ARDS患者の生存率の改善と関連している
N Engl J Med. 2015 Feb 19;372(8):747-55.
VV-ECMOの人工呼吸器の理想的な設定はコンセンサスが得られていない
通常はECMO回路はFiO2 1.0、スイープガス流量 2-5L/min、回転数 50-80ml/kg/minで設定される
ECMO下での管理で死亡率の低下と独立して関連した唯一の人工呼吸器パロメータは駆動圧の最小化であった
Intensive Care Med. 2016 Nov;42(11):1672-1684.
また他のレビューでは4ml/kgの一回換気量(ultra lung protective ventilation)が、標準的な6ml/kgよりも良いアウトカムをもたらす可能性が示唆された
まとめると現在VV-ECMO下で推奨される人工呼吸器管理は
・1回換気量を予測体重1kgあたり4-6mlに減らす
・プラトー圧を25cmH2O以下
・PEEP 10cmH2Oで維持
すること
また、別途の目標としては12-24時間以内に筋弛緩薬や肺血管拡張薬(NO)の離脱を行うこと
低酸素血症人間は極度の低酸素に耐える能力があり、エベレストの登山家は平均SaO2 54%(!?)、PaO2 25mmHgに耐えられる
N Engl J Med. 2009 Jan 8;360(2):140-9.
よってVV-ECMO中の許容SaO2レベルについてはコンセンサスが無い
ELSOガイドラインでは、心拍出量とヘモグロビンが適切ならSaO2 80-85%を目標として推奨している
VV-ECMOでの酸素飽和度の重要な決定因子は回路の酸素分率(通常はFiO2 1.0)、本来の心拍出量に対するECMO流量の比率、酸素消費量、本来の肺機能、再循環(recirculation)になる
一般的な原因としてはrecirculationと相対的にECMO流量が心拍出量より低いことが、低酸素血症の原因になる
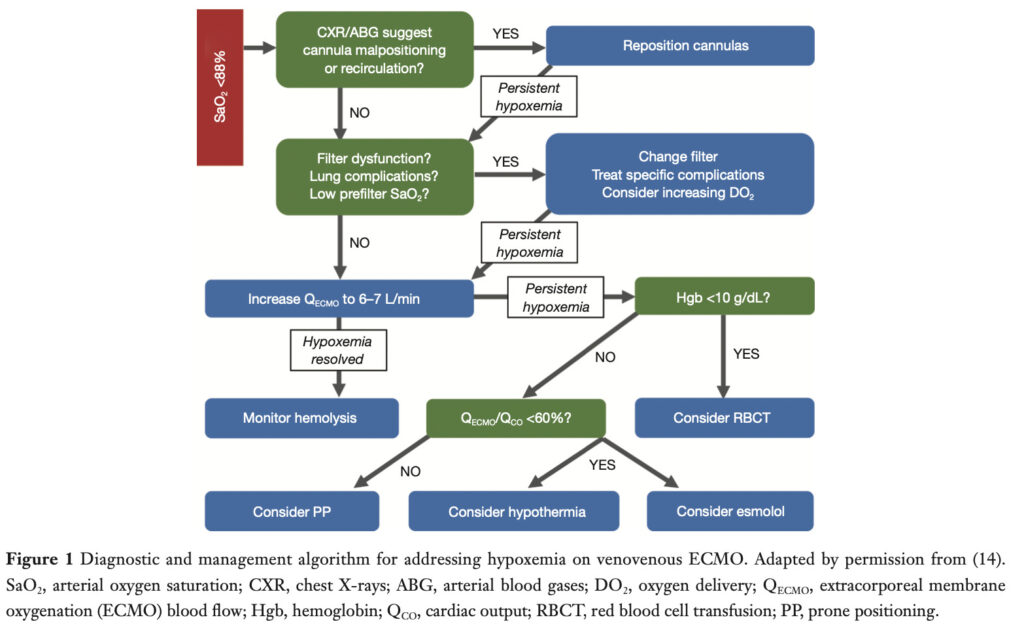
SpO2が低い場合にはLevyらのアプローチを参照することが良い
Intensive Care Med. 2015 Mar;41(3):508-10.
また低酸素血症(SaO2が低いだけ)と低酸素症(組織が低酸素状態)は区別しなければいけない
低酸素血症は簡単に測定できるが、低酸素症は乳酸などで間接的に評価するしかない
再循環(recirculation)典型的なrecirculationの兆候は低いSaO2と高いSpreO2
回路の流量を増やすとSaO2は改善するが、最終的にはrecirculationが増え有効な血流は減少する
計算式は
recirculation rate=(SpreO2-SvO2)/(SpostO2-SvO2)×100
SpreO2は人工肺に入る血液の酸素飽和度、SpostO2は人工肺から出る血液の酸素飽和度(こちらは1.0がほとんど)
recirculation率が高ければ、いくつかの手順を行う
①2ヶ所のVV留置部位があれば、脱血管と送血管を15cm目標で距離を空ける
②脱血管を追加して、回転数を下げて同量のフローを確保する
③デュアルルーメンカニューレに変更し送血管を三尖弁方向に向ける
心拍出量に対するECMO流量の比率典型的なECMOフローが3-4L/minの場合、一部はECMO回路を流れ、一部はECMO回路を通過して障害されている自己肺に流れる
これにより酸素化されたECMO血液と不十分に酸素化されたシャントの血液が混合され、総酸素飽和度(SaO2)は低下する
ECMO流量と心拍出量の比率が60%を超えていると、適切な酸素化が維持されることが示されている
最初に低酸素血症を見つけた時にECMOフローを増やすことは合理的な対応
また過度の自己心拍出量は比率を不均衡にし、低酸素血症を悪化させる可能性がある
そのためには高熱を避け、適切な鎮静鎮痛を行い、場合によってはβBの投与を行い自己心拍出量を抑制する
回路の管理
適切な抗凝固を行えない場合には、血栓形成を最小限にするため4-5L/minの高流量が良い
過度の溶血は小さすぎるカニューレ、不適切なカニューレ位置、高い回転数、回路内血栓によって生じる
回路内溶血で乳酸上昇する場合もある
膜での圧力降下は通常50mmHg未満で、100mmHgを超える変化は膜閉塞を強く示唆する
最適なヘモグロビンレベル一般論として重症患者において制限輸血戦略(Hb>7g/dl)はHb>10g/dlと比較して生存率は悪くなかった
しかしELSOは酸素供給の最適化のため、VV-ECMO中には正常なヘモグロビンレベル(12-14g/dl)を推奨している
抗凝固の問題歴史的に目標とするAPTTは60-80秒、あるいは正常の1.5-2.5倍としていた
ただ最近のEOLIA trialのようにAPTT 40-55秒とする、より低め管理で行うことも出ている
筆者の施設ではHb 8g/dl以上、血小板5万以上とし、出血が疑われる場合にはその都度PT、APTT、Fibの補正を行なっている
右室機能障害呼吸不全では肺血管収縮をきたし、右室機能不全を起こす可能性がある
初期管理としては肺血管拡張薬、強心薬、利尿薬を使用し、場合によっては右室機能障害の程度に応じてVV-ECMOかVA-ECMOかを考慮する必要がある
ただ多くの右室機能障害はVV-ECMOで管理でき、合併症も少なく済む
ただし改善しない右室機能障害がある場合には、右室アンロードのため、送血管を追加しVAV-ECMOに変更する必要がある
患者体位ARDS患者では腹臥位が生存率を大幅に改善することが示されている
腹臥位により肺のリクルートメントが最適化される
VV-ECMO患者での腹臥位は十分な訓練を受けたチームで安全に実施される
以上です
今回の症例は自己心が強くなりすぎて、自己肺(native lung)を回る血液が増えてしまい酸素化が悪くなったという経緯でした
自己心を抑えることで再度酸素化の改善を得られています
VV-ECMO難しいですが、うまく管理できるようになりたいものですね
本日はこの辺りで、ではでは


コメント