本日はCritical Careより重症患者での鉄の役割について扱ったレビュー論文を紹介します。
正直、あまり鉄動態とか気にして無かったのですが、ちょうど出ていたので一念発起して読んでみました。
Iron as an emerging therapeutic target in critically ill patients
Coralie Grange, François Lux, Thomas Brichart, et al.
Crit Care. 2023 Dec 4;27(1):475.
〈本論文の一言まとめ〉
鉄過剰は腎機能障害を中心として多臓器障害をきたしうる。
ただ鉄キレート剤などは副作用も多く、ICU領域での定まった治療は現状無い。
鉄は酸素運搬、DNA合成、ATP産生など重要な役割を担う。
鉄のホメオスタシスが乱れると、欠乏すれば貧血、過剰ならばヘモクロマトーシスが問題になる。
ヘモクロマトーシスは鉄過剰でよく知られているが、代謝の異常は敗血症や脳卒中、AKIなどとも関係している。
この論文では鉄過剰、特にトランスフェリンと結合していない鉄(non-transferrin bound iron:NTBI)と有害事象との関連について焦点を当てている。
ヒトは鉄を特異的に排泄する経路が欠乏しているため、鉄のホメオスタシスは吸収、移送、貯蔵、再利用を司るタンパクに依存している。
鉄は吸収されるとトランスフェリンと結合し標的臓器へ搬送される。大半は造血のために骨髄に運ばれ、約1.8g(全体で3-4g)がRBCに使われる。
健常者ではtransferrin saturation(TSAT)は30-35%未満と低いため、血漿中のNTBIを吸収することができる。
一方でヘモクロマトーシスのように鉄過剰であるとTSATは上昇し、NTBIは血中で容易に同定される。
そしてNTBIが上昇することは有害な活性酸素(reactive oxygen species:ROS)の産生を促進させるため、害になる。
この反応はFenton反応、Haber Weiss反応と呼ばれる。
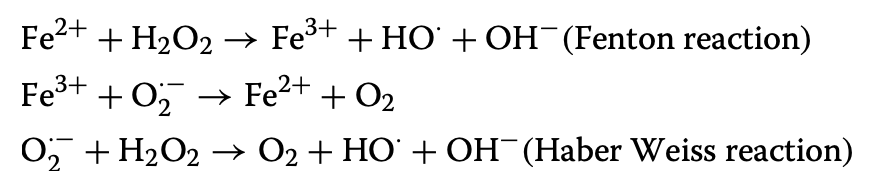
特に産生されたヒドロキシラジカルは高度に反応性であり、DNA分解や脂質の過酸化をきたす。
さらに新たに発見された細胞死に「ferroptosis」というものがあり、アポトーシスやネクローシスとは違うものの細胞内でROSによる脂質の障害による。
こちらはまだ完全には機序が解明されていないが、鉄キレートが細胞死を防いだとする報告もある。
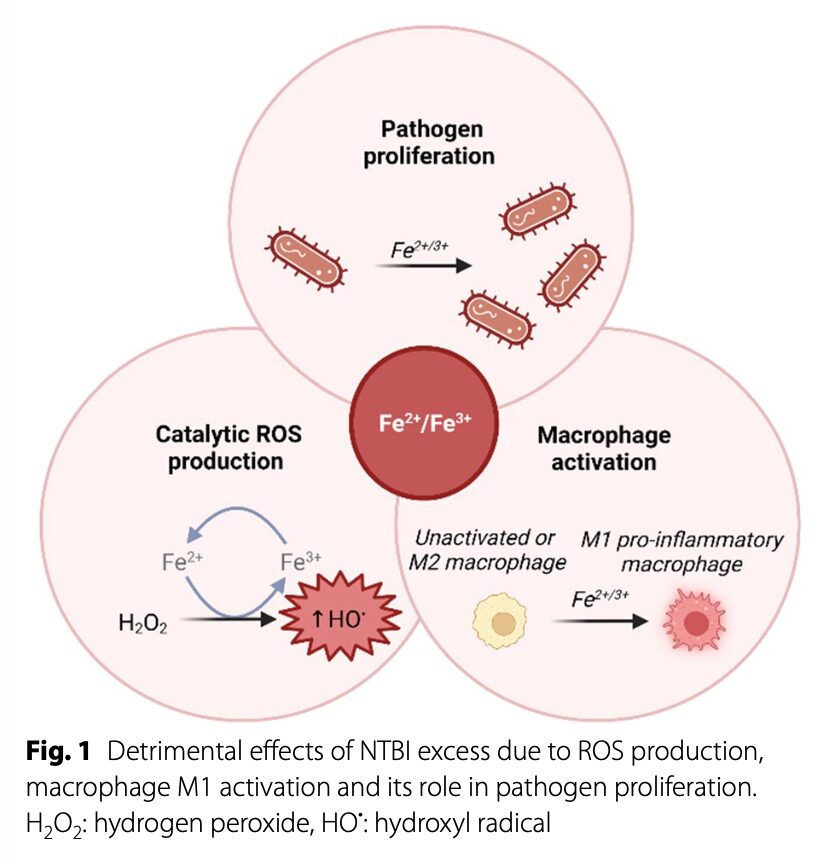
さらに鉄過剰は感染リスクとも関連する。
TSATが高く血漿にNTBIが存在することで、酸性化を好む細菌の成長が促進される。
またマクロファージの活性化もきたす。
まとめるとNTBIはROSを産生することによりマクロファージを活性化させ、病原体を増殖させ、活性酸素ストレスをきたし、重篤な細胞組織障害を生じる。
重症患者において鉄は有益性も毒性もあるので、ホメオスタシスの乱れが大きな影響となる。
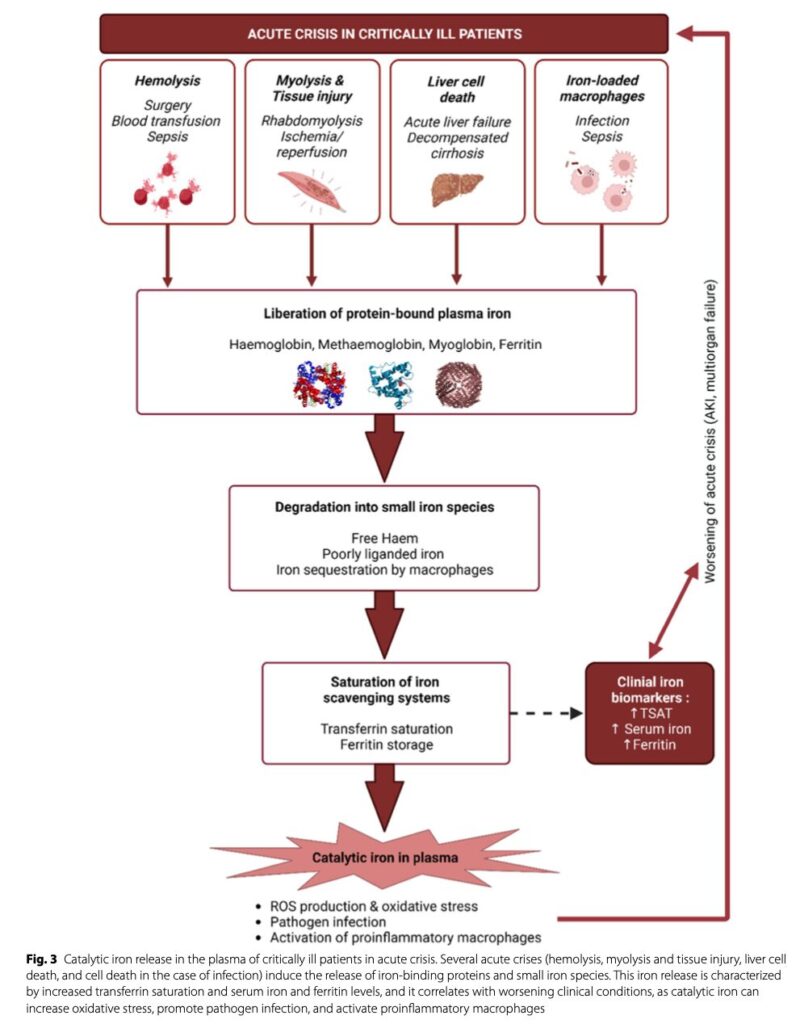
重症患者において急性の臓器障害により、血中へNTBIが放出されることはしばしば経験する。
赤血球は体内の貯蔵鉄の大半を占めている。溶血によるAKIの機序はNTBIにより酸化ストレス、炎症反応、NO減少に伴い腎臓にダメージを及ぼすからとされる。
鉄は筋肉内においてミオグロビンと結合している。そのため激しい筋損傷(横紋筋融解)が起こるとミオグロビンだけでなく鉄も血中へ放出される。この際にAKIはミオグロビンによる腎障害でも起きるが、NTBIによる酸化ストレスも影響している。また虚血や再灌流障害により形成された酸性環境もNTBIの放出を惹起する。
肝臓は鉄ホメオスタシスに極めて重要な役割を担うこともあり、肝細胞障害でもNTBIによる組織障害を生じる。
敗血症患者で病原体に対しての免疫機序の一つに鉄を取り込み、鉄利用を防ぐことがあるが、これは炎症性の貧血をきたす。COBID-19で貧血を含み鉄動態が乱れることが報告され、最近では「ferroptosis」により心血管障害をきたしうることが示された。
血清鉄の高値はICU転帰不良と相関した。
NTBIは前述の理由で組織障害をきたし、ICUでの転帰を悪化させる報告がある。
中にはTSAT低値であることが生存予後の改善と関連したとするものもある。
NTBIは特にAKIのケースなどにおいて、重症患者において治療対象となる。治療戦略として以下の3つがある。
①鉄代謝を標的とする方法
フェリチンは鉄代謝を進める。そのためヘプシジンの投与はフェリチンを増やすことにより腎保護作用をきたす可能性がある。
あるいは遊離ヘモグロビンを除去するハプトグロビンの投与も治療となる可能性がある。日本において販売されており、輸血や体外循環、熱傷に伴っての溶血の治療で投与される。
②鉄キレート
キレート療法は凝固障害や輸血による鉄過剰に伴う二次性のヘモクロマトーシスの治療として位置付けられていた。最近になり動物だけでなくヒトでも、鉄キレートによりAKIを予防することができると報告されたものの、まだ報告は限られている。また現在心臓血管外科術後にデフェロキサミン(DFO)を投与することで、AKIを予防するかを評価するRCTが行われている(DEFEAT-AKI trial)。他の戦略としてDFOと抗酸化剤の投与があり、NアセチルシステインとDFOをショック患者に投与した研究もある。この結果はAKIを減らすことは無かったが、AKIの重症度は下げたというものであった。
鉄キレート剤として、DFO、デフェリプロン、デフェラシロクス(DFX)の3剤がFDAより鉄過剰の治療として認められている。
しかしDFXは尿細管壊死をきたすことがあり、同機序でのAKIが起こりやすいICUにおいては使用しにくい。第二選択となるデフェリプロンは半減期が1.5-2.5hと短く、経口投与に限られる点がICUでの使用を妨げることがある。
また感染合併下においては細菌のシデロフォアよりも鉄との親和性が高くなければならない。DFOは天然のシデロフェアであり、ある種の病原体に関しては感染リスクを増大させる。そのため前述のDEFEAT-AKI trialにおいても、菌血症は除外されている。ただ最近では抗菌作用のあるキレート剤も出てきている。
一般的な鉄過剰に対する鉄キレート剤の有効性は証明されているが、副作用のためICUにおける急激な鉄の上昇に対しての使用は適していない可能性がある。だがキレートポリマーを含む新しいキレート剤は今後の選択肢になりうるため、新しい臨床研究の知見が待たれる。
③RRTとキレートの併用
RRTを行うAKI患者における鉄除去のためにキトサン系キレートポリマーを血液透析と併用する方法が提案されている。
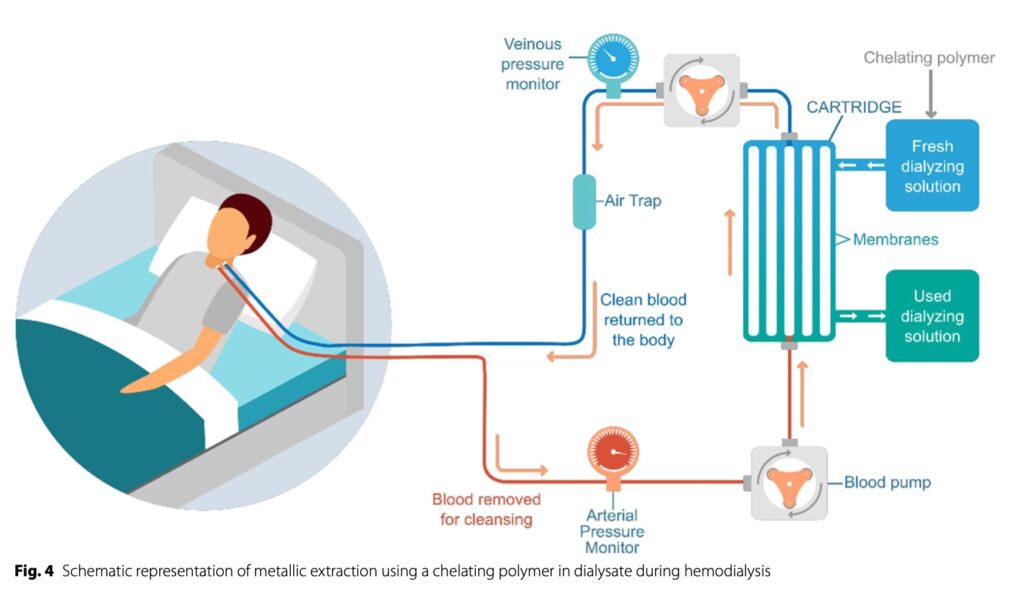
これにより金属が抽出され、血液中へは戻らなくなる。透析を行うAKI患者に行えれば、追加の治療などを大幅に変更することなく治療を提供できる。ただこの機器を使用するには臨床試験をまず行うことが必要となる。
いかがだったでしょうか。
軽視されがちな鉄過剰ですが、さまざまな機序から臓器障害をきたします。
一方でキレート剤には副作用(AKIや消化器症状)があり、ICUでは安易には使えないのが実情です。
鉄過剰を防ぐため余計な輸血製剤使用は控え、なるべく早期に原疾患を治療するくらいしか出来ることは無いですかね。
面白い文献でした。ではでは。


コメント